On sépare souvent le monde minéral et le monde vivant et pourtant les deux sont bien plus intimement liés qu’on ne l’imagine. Ainsi ce sont les premiers êtres vivants, les cyanobactéries, qui ont introduit le dioxygène (O2) dans l’atmosphère terrestre (permettant ensuite l’éclosion de formes de vie plus complexes).

- Les premiers stromatholites, fossilisés, datent de plus de 3 milliards d’années. Ils sont la trace des premières formes de vies en colonies fixées, © National Park Service
Ce que l’on soupçonne encore moins, c’est que l’immense majorité des roches calcaires sont elles aussi issues d’un processus faisant intervenir des êtres vivants. Les bactéries ont également modifié la chimie de l’océan primitif en favorisant la précipitation des carbonates dissous et produisant ainsi de gigantesques constructions calcaires, les stromatolithes, un processus qui eut certainement un impact considérable sur l’évolution biologique elle-même.
Il y a environ 540 millions d’années, un grand nombre de formes biologiques appartenant aux Eucaryotes —leurs cellules possèdent un noyau— se sont révélées capables, à leur tour, de produire des structures calcaires. Ce phénomène diffère beaucoup de la précipitation calcaire d’origine bactérienne car les Eucaryotes maîtrisent cette cristallisation qui leur permet de générer des structures fonctionnelles. Ainsi de nos jours, l’escargot ou l’huître fabriquent des coquilles en calcaire dont ils ne contrôlent pas seulement la forme mais également la disposition et même la nature des cristaux qui les constituent. Il existe deux formes principales de calcaire (qui ont la même composition chimique CaCO3 mais des organisations cristallines différentes) : la calcite et l’aragonite. La coquille de l’escargot est en aragonite, celle de l’huître en calcite. Les « huîtres perlières » (qui ne sont pas de véritables huîtres sur le plan zoologique), maîtrisent les deux cristallisations : la calcite pour la couche extérieure de la coquille et la nacre (de l’aragonite) à l’intérieur. Elles peuvent même en recouvrir un objet intrus, formant ainsi une précieuse perle. Les ormeaux, gastéropodes très recherchés pour leur coquilles nacrées (mais également leur chair dans la cuisine chinoise… et bretonne !), fabriquent des coquilles à 3 couches : une couche de prismes de calcite emprisonnées entre 2 couches d’aragonite.

- Coupe d’une coquille de Pinctada Margaritifera, "huître" perlière © J.P. Cuif
Des images de coupes de ces coquilles montrent à quel point la cristallisation est parfaitement contrôlée au micron près, strate par strate par l’animal, qui peut lui donner la forme qui convient. Comment y parvient-il ?
Anatomie d’un mollusque
Le corps de ces animaux est entouré d’un organe appelé "manteau", dont la couche cellulaire extérieure va secréter tous les éléments nécessaires à la constitution de la coquille. Entre la coquille et le manteau, dans un fluide isolé de l’extérieur par une membrane organique (le périostracum), la cristallisation du calcaire de la coquille prend place, couche après couche, jour après jour. Quel est le secret de fabrication de ces biominéraux que le meilleur chimiste ne saurait reproduire dans une éprouvette ?
Pour le savoir, les techniques se sont succédé au cours du XIXème et du XXème siècle. On a d’abord pu montrer que les coquilles des mollusques n’étaient pas du calcaire pur mais contenait de la matière organique : protéines, polysaccharides (sucres complexes). Ces grosses molécules organiques, apportées par l’animal, semblent servir de trame à la cristallisation du calcaire. Grâce à des expériences utilisant le rayonnement synchrotron de l’ESRF [1] (Grenoble) ou bien encore le spectromètre de masse de l’ICSN [2] à Gif sur Yvette, on a pu mieux caractériser la nature de ces molécules et montrer qu’elles étaient très variées (selon l’animal, la phase de calcaire à produire). C’est l’animal qui contrôle cette biochimie subtile, intimement liée également à son cycle de vie. Les recherches actuelles étudient à l’échelle nanométrique les rapports entres composés organiques et phases minérales à l’intérieur même de ces strates de croissance d’épaisseur micrométriques, grâce à la microscopie à force atomique.
La mémoire des coraux
Les mollusques ne sont pas les seuls animaux concernés par la biominéralisation. Un autre exemple très connu est celui des coraux. L’animal —qui appartient à l’embranchement des Cnidaires = animaux urticants, comme les méduses— forme un squelette de calcaire et la réunion de ces animaux en colonies permet l’édification de grandes barrières capables de modifier les conditions géographiques locales (barrière contre les vagues), quelquefois à très grande échelle comme la Grande Barrière récifale qui borde la côte Est de l’Australie.

- Image satellite d’une partie de la grande barrière de corail ©NASA
Grâce aux microscopies modernes qui permettent de voir à l’échelle du nanomètre, on commence à comprendre le déroulement de la cristallisation du calcaire sous l’animal et le rôle de la trame organique dans l’agencement des micro-domaines cristallins. Ces coraux sont utilisés par les scientifiques à des fins très diverses. Citons deux exemples. Au Laboratoire des Sciences du Climat et de l’Environnement - CNRS de Gif, ils sont étudiés comme archives de la température des océans. La température de l’eau influence en effet l’incorporation d’un isotope minoritaire de l’oxygène (l’oxygène 18) au moment de la cristallisation. Sur un fragment de construction édifiée par les coraux, on remonte à la température à laquelle le calcaire a cristallisé en mesurant l’évolution de cette proportion tout au long de la colonie. Cette méthode est largement utilisée pour d’autres structures calcaires biologiques (Foraminifères, Mollusques, etc.). La particularité du processus de biocristallisation est bien mise en évidence par le fait que, des animaux d’espèces différentes, vivant dans le même micro-environnement local, incorporent cet oxygène 18 dans une proportion qui est propre à chaque espèce, et différente de la proportion mesurée dans des cristaux produits, à la même température, par un procédé purement chimique. C’est à ce phénomène spécifiquement biologique que H.C. Urey, initiateur de la méthode, a donné le nom "d’effet vital". Il justifie une recherche approfondie sur les modalités de la cristallisation biologique, pour parvenir à une meilleure exploitation des archives naturelles que constituent les biocristaux.
Autre application, médicale cette fois-ci : les prothèses en corail. Ce matériau a été utilisé dans les années 90 pour remplacer des morceaux d’os humain. Il présente des critères de solidité et de façonnabilité remarquables. Certains coraux sont déjà naturellement pourvus de cavités permettant aux vaisseaux sanguins de coloniser rapidement l’intérieur de l’implant. De plus, ils sont progressivement « digérés » et remplacés par de l’os humain (notre squelette se renouvelle ainsi naturellement tous les 10 ans, environ). Cependant, malgré les précautions préparatives, l’introduction de matériel corallien dans le milieu intérieur entraînait quelquefois des réaction inflammatoires dont l’origine est demeurée longtemps incomprise. La diversité biochimique des phases organiques minéralisantes, moteur du phénomène de résorption, pourrait bien être également la cause de ces difficultés occasionnelles.
Les perles de Tahiti.
Pour terminer, Jean-Pierre Cuif emmène les participants au pays des "perles noires"… en Polynésie. Comme mentionné au début de cet article, les huîtres perlières sont capables de recouvrir de nacre – de l’aragonite - un corps étranger (un mécanisme de défense en quelque sorte) et fabriquent ainsi des perles qui sont d’autant plus brillantes que les couches de nacre sont fines et régulières. Mais les perles naturelles sont rares, très rares.
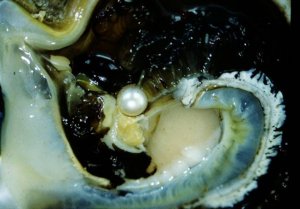
- Perle de culture à l’intérieur de "l’huître" © J.P. Cuif
Alors, nombreux sont ceux qui ont essayé d’en produire artificiellement. Le maître parmi eux, le japonais Kokishi Mikimoto breveta la technique de fabrication des perles, mise au point par Mise et Nishikawa (1907). Elle consiste à introduire dans la cavité viscérale d’une huître perlière une sphère calcaire (le nucleus) sur laquelle on dépose un petit fragment du manteau d’une autre huître qui recouvrira le nucleus et formera la future perle. Ces gestes véritablement chirurgicaux, longtemps demeurés le secret des greffeurs japonais, sont maintenant enseignés dans les écoles spécialisées des pays producteurs. En outre d’importants programmes de recherche sont lancés, en Polynésie notamment, pour améliorer la technique de production, recherche qui bien naturellement implique une étude des gènes concernés par le processus de biocristallisation. Un bel exemple de conjonction entre recherche fondamentale et applications, d’importance majeure pour une région telle que la Polynésie.
On l’aura compris, le décryptage du mystère de ces matériaux fabriqués par des êtres vivants, huîtres, coquillages, coraux… mobilise un grand nombre de communautés scientifiques : géologues, physiciens, chimistes et biologistes…
 COMPAS - vulgarisation scientifique
COMPAS - vulgarisation scientifique